팍스로비드™ (Paxlovid™)

성상
이 약은 니르마트렐비르 2정과 리토나비르 1정이 함께 포장된 제품임
- 니르마트렐비르(nirmatrelvir)(영미권에서는 ‘닐마트렐비어’로 발음합니다)
→ 분홍색의 타원형 필름코팅정제 - 리토나비르(ritonavir)(영미권에서는 ‘리토나비어’로 발음합니다)
→ 흰색의 장방형 필름코팅정제
원료약품 및 그 분량
- 니르마트렐비르 1정(772.5mg) 중 니르마트렐비르(nirmatrelvir) 150mg
- 리토나비르 1정(787.4mg) 중 리토나비르(ritonavir) 100mg
효능·효과
PCR 검사 등을 통해 코로나 바이러스 감염증-19가 확진된 환자로서, 중증으로 진행될 위험이 높은 경증 및 중등증 성인 및 소아(12세 이상이고 체중 40kg 이상) 환자의 치료
- 이 약은 중증 또는 치명적인 코로나19로 입원이 필요한 환자에서의 치료 시작에 대한 효과가 입증되지 않았음
- 이 약은 코로나19의 노출 전 또는 노출 후 예방효과가 입증되지 않았음
- 이 약은 연속 5일보다 긴 기간의 사용효과에 대해 입증되지 않았음
용법·용량
- 용량
- 이 약은 니르마트렐비르정과 리토나비르정이 함께 포장되어 있다.
- 니르마트렐비르는 리토나비르와 함께 투여되어야 한다. 만약 리토나비르와 동시에 병용투여되지 않을 경우, 니르마트렐비르의 치료적 효과를 위해 필요한 혈중 농도에 충분하게 도달하지 못한다.
- 니르마트렐비르 300mg(150mg 2정)와 리토나비르 100mg(100mg 1정)을 함께 복용하며 1일 2회로 5일 동안 경구투여한다.
- 처방 시 이 약의 각 주성분(니르마트렐비르 및 리토나비르)의 복용 용량이 명시되어야 한다. 바이러스 제거를 최대화하고 코로나19의 전파를 최소화하기 위해 5일간의 전체 치료 과정을 완료하고 공중 보건 권고에 따라 격리를 유지하는 것이 중요하다.
- 이 약은 코로나19 양성 진단을 받고 가능한 빨리, 그리고 증상 발현 후 5일 이내에 투여가 시작되어야 한다. 환자가 이 약으로 치료를 시작한 후 코로나19로 인한 입원이 필요한 경우에도 전체 5일간의 치료 과정을 완료해야 한다.
- 이 약의 복용을 잊은 경우, 복용 예정 시간으로부터 8시간을 경과하지 않았다면 즉시 예정된 용량을 복용한다. 만약 복용 예정 시간으로부터 8시간을 경과한 경우라면 그 다음번의 복용 예정 시간에 정해진 용량을 복용한다. 잊은 복용량을 보충하기 위해 예정된 복용량을 두 배로 늘려서 복용하지 않아야 한다.
- 이 약(니르마트렐비르 및 리토나비르 정제 모두)은 식사와 관계없이 복용할 수 있다.
- 이 약은 통째로 삼켜야 하며 씹거나 부수지 않아야 한다.
- 특수환자군
1) 신장애 환자 – 중요 투여 정보
경증의 신장애 환자(eGFR ≥60 – <90 mL/min)에서 용량조절은 필요하지 않다.
중등도의 신장애 환자(eGFR ≥30 ~ <60 mL/min)에서, 이 약의 용량은 니르마트렐비르 150 mg과 리토나비르는 100 mg을 1일 2회 5일간투여로 감량한다. 처방 시에는 이 약 각 활성성분의 복용량을 명확히 해야 한다. 의료전문인은 환자에게 신장애관련 투여방법에 대해 설명을 해야 한다. 향후 충분한 자료가 확보될 때까지 중증 신장애(eGFR <30 mL/min) 환자에게 이 약은 권장되지 않는다. 중증 신장애환자에서 적절한 투여용량은 확립되지 않았다.
2) 간장애 환자
경증(Child-Pugh 등급A) 또는 중등도(Child-Pugh 등급B) 간장애 환자에서 용량조절은 필요하지 않다. 중증 간장애(Child-Pugh C등급) 환자에서 니르마트렐비르 또는 리토나비르의 사용과 관련한 약동학적 자료나 안전성 자료는 없다. 따라서 이 약은 중증 간장애 환자에게 사용이 권장되지 않는다.
3) 이 약과의 중요 약물 상호작용
리토나비르 또는 코비시스타트(cobicistat)를 함유하는 다른 의약품과 병용투여 시 용량조절은 필요하지 않다.
리토나비르 또는 코비시 스타트-함유 HIV 또는 HCV 요법을 투여 중인 환자는 필요에 따라 투여를 지속한다.
이 약과의 중요한 약물 상호작용에 대해서는 제품설명서의 다른 항목을 참조한다. 이 약 투여 전 및 투여 중 약물 상호작용의 가능성을 고려하고, 이 약 투여 중 병용약물을 검토한다.
사용상의 주의사항
- 다음 환자에는 투여하지 말 것
1) 이 약의 주성분(니르마트렐비르 또는 리토나비르)이나 첨가제에 과민반응(예: 독성 표피 괴사(TEN), 스티븐스-존슨 증후군)의 병력이 있는 자
2) 체내 청소율이 CYP3A에 매우 의존적이고, CYP3A에 의해 약물 농도가 크게 상승할 경우 중대하거나 생명을 위협하는 반응이 있는 약물과의 병용투여
- 알파1-아드레날린 수용체 길항제: 알푸조신
- 진통제: 페티딘, 피록시캄, 프로폭시펜
- 항협심증약: 라놀라진
- 항부정맥약: 아미오다론, 드로네다론, 플레카이니드, 프레파페논, 퀴니딘
- 항통풍약: 콜키신
- 항정신병약: 루라시돈, 피모자이드, 클로자핀
- 맥각 유도체: 디히드로에르고타민, 에르고타민, 메틸에르고노빈
- HMG-CoA 환원효소 억제제: 로바스타틴, 심바스타틴
- PDE5 억제제: 폐동맥 고혈압 치료에 사용되는 실데나필(레바티오®)
- 진정제/수면제: 트리아졸람, 경구용 미다졸람
3) 강력한 CYP3A 유도제인 약물과의 병용요법
: 니르마트렐비르/리토나비르의 혈장 농도가 현저히 감소하여 바이러스 반응의 손실 및 내성(resistance)의 가능성이 있다. 이 약은 최근 중단된 CYP3A 유도제의 지연된 효과(offset)로 인해 다음 약물 중 하나를 중단한 직후에는 시작할 수 없다.
- 항암제: 아팔루타미드
- 항경련제: 카르바마제핀, 페노바르비탈, 페니토인
- 항진균제: 리팜핀
- 생약 제제: 세인트 존스 워트(hypericum perforatum)
- 다음 환자에는 신중히 투여할 것
1) 신장애 환자(‘용법용량 2. 특수환자군’ 참조)
2) 간장애 환자(‘용법용량 2. 특수환자군’ 참조)
3) 기존에 리토나비르 또는 코비시스타트(cobicistat)를 함유하는 의약품을 복용중인 환자(‘용법용량 2. 특수환자군’ 참조)
- 이상반응
1) 임상시험 중 보고된 이상반응
이 약의 임상시험 중 다음과 같은 이상반응이 관찰되었다. 이러한 임상시험에서 관찰된 이상반응의 비율은 다른 약물에 대한 임상적 사용에서 관찰되는 이상반응의 비율과 직접적으로 비교할 수 없다. 이 약을 광범위하게 사용할 경우 추가적인 이상반응이 발생할 수 있다.
이 약의 안전성은 실험실 검사 결과 감염이 확인된 비입원 코로나19 성인 환자를 대상으로 한 무작위 배정, 위약 대조, 2/3상 임상시험 (시험번호 C4671005 (EPIC-HR))의 자료를 근거로 한다. 18세 이상의 성인으로 하나 이상의 중증 이환 위험인자가 있는 코로나19 유증상 환자 총 2,224명이 이 약 또는 위약을 1회 이상 투여받았다(시험군 1,109명, 위약군 1,115명). 이상반응은 임상시험용의약품의 첫 번째 투여 후 제34일 까지 관찰하여 보고되었다. 이 약(니르마트렐비르/리토나비르 300/100mg) 또는 이에 상응하는 위약은 1일 2회, 5일간 투여되었다.
시험군에서 빈번하게 보고된 이상반응(≥1%) 중 위약군 대비 더 높은 빈도(≥5명 이상 차이)로 보고된 이상반응(인과성에 관계없이 모든 등급 포함)은 미각이상(시험군 6%, 위약군 <1%), 설사(시험군 3%, 위약군 2%), 고혈압(시험군 1%, 위약군 <1%) 및 근육통(시험군 1%, 위약군 <1%)이었다.
이상반응으로 인해 투약을 중단한 환자의 비율은 시험군에서 2%, 위약군에서 4%였다.
- 일반적 주의
이 약의 임상정보는 제한적이다. 이전에 보고되지 않은 예상하지 못한 중대한 이상반응이 발생할 수 있으므로 이 약을 투여 받는 환자에 대한 임상적, 실험실적 모니터링을 주의 깊게 실시하여야 한다.
1) 약물 상호작용으로 인한 중대한 이상반응의 위험
이 약은 CYP3A 억제제이다. 따라서 CYP3A에 의해 대사되는 약물을 투여받는 환자에서 이 약의 사용을 시작할 경우, 또는 이미 이 약을 투여하고 있는 환자에서 CYP3A에 의해 대사되는 약물의 사용을 시작할 경우에는 CYP3A에 의해 대사되는 약물의 혈장 농도가 증가할 수 있다. 이 약을 투여하고 있는 환자에서 CYP3A를 억제하거나 또는 유도하는 약물의 사용을 시작할 경우, 이 약의 혈장 농도를 증가 또는 감소시킬 수 있다. 이와 같은 상호작용은 아래의 결과를 유발할 수 있다.
- 병용약물의 체내 노출의 증가로 인한 잠재적으로 심각하거나, 생명을 위협하거나 또는 치명적인 임상적으로 중대한(Significant) 이상반응
- 이 약의 체내 노출의 증가로 인한 임상적으로 중대한(Significant) 이상반응
- 이 약의 치료 효과의 상실 및 바이러스 내성(viral resistance)의 가능성
이 약의 치료 전과 치료 중 약물 상호작용의 가능성은 이 약과의 투여 금기(표 1)를 참고해야 한다. 잠재적으로 중요한 약물 상호작용을 고려하고, 이 약의 치료 중 병용약물을 검토하고 병용약물과 관련된 이상반응을 모니터링해야 한다.
2) 간 독성
리토나비르를 투여받은 환자에서 간 트렌스아미나제의 상승, 임상적 간염(clinical hepatitis) 및 황달이 보고되었다. 따라서 기존에 간 질환, 간 효소 이상 또는 간염이 있는 환자에게 이 약을 투여할 때에는 주의해야 한다.
3) HIV-1 내성 발현의 위험
니르마트렐비르는 리토나비르와 병용하여 투여되기 때문에 조절되지 않거나 진단되지 않은 HIV-1 감염이 있는 사람에서 HIV 프로테아제 억제제에 대한 내성이 발생할 위험이 있다.(용법·용량, 투여 금기, 약물 상호작용 항 참조)
- 약물 상호작용
1) 이 약이 다른 약물에 영향을 미칠 가능성
이 약(니르마트렐비르/리토나비르)은 CYP3A의 억제제로서 CYP3A에 의해 주로 대사되는 약물의 혈장 농도를 증가시킬 수 있다. 체내 제거에서 CYP3A에 크게 의존하고, CYP3A에 의해 약물 농도가 크게 상승할 경우 중대하거나 생명을 위협하는 반응이 있는 약물은 이 약과 병용 금기이다(투여 금기 및 표 1 참조). CYP3A의 기질과의 병용투여는 표 1과 같이 용량 조절 또는 추가적인 모니터링이 필요할 수 있다.
2) 다른 약물이 이 약에 영향을 미칠 가능성
이 약(니르마트렐비르/리토나비르)은 CYP3A의 기질이다. 따라서 CYP3A를 유도하는 약물은 이 약의 혈장 농도와 치료 효과를 감소시킬 수 있다.
3) 확립된 또는 기타 잠재적으로 중요한 약물 상호작용
표 1은 금기 약물을 포함하여 임상적으로 중요한 약물 상호작용을 포함한다. 표 1에 포함된 약물은 예시(guide)로서 이 약과 상호작용할 수 있는 모든 약물로 간주되면 안된다. 처방의는 포괄적인 정보에 대해 적절한 참고자료 등을 활용해야 한다(투여 금기 항 참조).
표 1: : 확립된 상호작용 및 기타 잠재적으로 중요한 약물 상호작용
| 약물 계열 | 성분명 | 농도에의 영향 | 임상적 견해(Clinical Comments) |
|---|---|---|---|
| 알파1-아드레날린 수용체 길항제 | 알푸조신 | ↑알푸조신 | 저혈압의 가능성으로 인해 병용투여 금기 |
| 진통제 | 페티딘 피록시캄 프로폭시펜 | ↑페티딘 ↑피록시캄↑ 프로폭시펜 | 심각한 호흡억제 또는 혈액학적 이상의 가능성으로 병용투여 금기 |
| 항협심증약 | 라놀라진 | ↑라놀라진 | 중대한 및/또는 생명을 위협하는 반응의 가능성으로 병용투여 금기 |
| 항부정맥약 | 아미오다론 드로네다론 플레카이니드 프레파페논 퀴니딘 | ↑항부정맥약 | 심장 부정맥의 가능성으로 인해 병용투여 금기 |
| 항부정맥약 | 베프리딜 리도카인(전신투여) | ↑항부정맥약 | 주의하여 투여해야 하며, 가능한 경우 항부정맥약의 치료 농도 모니터링이 권장됨 |
| 항암제 | 아팔루타마이드 | ↓니르마트렐비르/리토나비르 | 바이러스 반응의 손실 및 내성 발현의 잠재적인 가능성으로 인해 병용투여 금기 |
| 항암제 | 아베마시클립 세리티닙 다사티닙 엔코라페닙 아이보시데닙 네라티닙 닐로티닙 베네토클락스 빈블라스틴 빈크리스틴 | ↑항암제 | 엔코라페닙 또는 아이보시데닙은 QT 간격 연장과 같은 중대한 이상반응의 잠재적 위험으로 인해 병용투여는 권장되지 않음 네라티닙, 베네토클락스 또는 이브루티닙의 병용투여는 권장되지 않음 빈블라스틴과 빈크리스틴의 병용은 심각한 혈액학적 또는 위장관 부작용을 유발할 수 있음 추가적인 정보는 해당 항암제의 허가사항을 참고할 것 |
| 항응고제 | 와파린 | ↑↓와파린 | 와파린과의 병용투여가 필요한 경우 INR을 모니터링 할 것 |
| 항응고제 | 리바록사반 | ↑리바록사반 | 출혈 위험의 증가로 인해 병용투여를 피해야 함 |
| 항경련제 | 카르바마제핀a 페노바르비탈 페니토인 | ↓니르마트렐비르/리토나비르 ↑카르바마제핀 ↓페노바르비탈 ↓페니토인 | 바이러스 반응의 손실 및 내성 발현의 잠재적인 가능성으로 인해 병용투여 금기 |
| 항우울제 | 부프로피온 | ↓부프로피온 및 활성대사체인 히드록시-부프로피온 | 병용투여 시 부프로피온에 대한 임상적 반응을 모니터링 할 것 |
| 항우울제 | 트라조돈 | ↑트라조돈 | 트라조돈을 리토나비르와 병용투여할 때 오심, 현기증, 저혈압 및 실신의 이상반응이 관찰된 바, 트라조돈의 용량을 낮추는 것을 고려해야 함 추가적인 정보는 트라조돈의 허가사항을 참고할 것 |
| 항진균제 | 보리코나졸 | ↓보리코나졸 | 병용투여는 권장되지 않음 |
| 항진균제 | 케토코나졸 황산이사부코나조늄 이트라코나졸a | ↑케토코나졸 ↑황산이사부코나조늄 ↑이트라코나졸a | 추가적인 정보는 해당 항진균제의 허가사항을 참고할 것 |
| 항통풍약 | 콜키신 | ↑콜키신 | 신장 및/또는 간 장애가 있는 환자에서 중대한 및/또는 생명을 위협하는 반응의 가능성으로 병용투여 금기 |
| 항-HIV 프로테아제 억제제 | 암프레나비르 아타자나비르 다루나비르 포삼프레나비르 인디나비르 넬피나비르 사퀴나비르 티프라나비르 | ↑프로테아제 억제제 | 추가적인 정보는 해당 프로테아제 억제제의 허가사항을 참고할 것리토나비르 또는 코비시스타트-함유 HIV 요법을 투여 중인 환자는 처방에 따른 투여를 지속할 것. 병용투여 시 이 약 또는 프로테아제 억제제의 이상반응 증가 여부를 모니터링 할 것 |
| 항-HIV 약물 | 디다노신 델라비르딘 에파비렌즈 마라비록 넬비라핀 랄테그라비르 지도부딘 빅테그라비르/엠시트라빈/테노포비르 | ↑디다노신 ↑에파비렌즈 ↑마라비록 ↓랄테그라비르 ↓지도부딘 ↑빅테그라비르/↔엠시트라빈/↑테노포비르 | 추가적인 정보는 해당 항-HIV 약물의 허가사항을 참고할 것 |
| 항생제(Anti-infective) | 클라리스로마이신 에리스로마이신 | ↑클라리스로마이신 ↑에리스로마이신 | 항생제의 용량조절은 해당 항생제의 허가사항을 참고할 것 |
| 항균제(Antimycobacterial) | 리팜핀 | ↓니르마트렐비르/리토나비르 | 바이러스 반응의 손실 및 내성 발현의 잠재적인 가능성으로 인해 병용투여 금기 리파부틴과 같은 다른 항진균제로의 대체를 고려할 것 |
| 항균제(Antimycobacterial) | 베다퀼린 | ↑베다퀼린 | 추가적인 정보는 베타퀼린의 허가사항을 참고할 것 |
| 항균제(Antimycobacterial) | 리파부틴 | ↑리파부틴 | 리파부틴의 용량감량은 리파부틴의 허가사항을 참고할 것 |
| 항정신병약 | 루라시돈 피모자이드 클로자핀 | ↑루라시돈 ↑피모자이드 ↑클로자핀 | 심장 부정맥과 같은 중대한 및/또는 생명을 위협하는 반응으로 병용투여 금기 |
| 항정신병약 | 쿠에티아핀 | ↑쿠에티아핀 | 병용투여가 필요한 경우, 쿠에티아핀의 용량을 감량하고 관련 이상반응을 모니터링 할 것 추가적인 정보는 쿠에티아핀의 허가사항을 참고할 것 |
| 칼슘 채널 차단제 | 암로디핀 딜티아젬 펠로디핀 니카르디핀 니페디핀 | ↑칼슘 채널 차단제 | 주의하여 투여해야 하며, 환자에 대한 임상 모니터링이 권장됨 병용투여 시 칼슘 채널 차단제의 용량 감량이 필요할 수 있음 추가적인 정보는 해당 칼슘 채널 차단제의 허가사항을 참고할 것 |
| 심장 배당체 | 디곡신 | ↑디곡신 | 병용투여 시 혈청 디곡신 수치를 모니터링하며 주의하여 투여할 것 추가적인 정보는 디곡신의 허가사항을 참고할 것 |
| 엔도텔린 수용체 길항제 | 보세탄 | ↑보세탄 | 이 약의 투여 시작으로부터 최소 36시간 전에 보세탄의 사용을 중단할 것 추가적인 정보는 보세탄의 허가사항을 참고할 것 |
| 맥각 유도체 | 디히드로에르고타민 에르고타민 메틸에르고노빈 | ↑디히드로에르고타민 ↑에르고타민 ↑메틸에르고노빈 | 사지 및 중추신경계를 포함하는 기타 조직의 혈관 경련 및 허혈을 특징으로 하는 급성 맥각 독성의 잠재적인 가능성으로 인해 병용투여 금기 |
| 직접 작용-HCV | 엘바스비르/그라조프레비르 글레카프레비르/피브렌타스비르 옴비타스비르/파리타프레비르/리토나비르 및 다사부비르 소포스부비르/벨파타스비르/복실라프레비르 | ↑항바이러스제 | 증가된 그라조프레비르 농도는 ALT 상승을 유발할 수 있음 리토나비르와 글레카프레비르/피브렌타스비르의 병용투여는 권장되지 않음 추가적인 정보는 옴비타스비르/파리타프레비르/리토나비르 및 다사부비르의 허가사항을 참고할 것 추가적인 정보는 소포스부비르/벨파타스비르/복실라프레비르의 허가사항을 참고할 것 리토나비르-함유 HCV 요법을 투여 중인 환자는 처방에 따른 투여를 지속할 것. 병용투여 시 이 약 또는 HCV의 이상반응 증가 여부를 모니터링 할 것 |
| 생약 제제 | 세인트 존스 워트 | ↓니르마트렐비르/리토나비르 | 바이러스 반응의 손실 및 내성 발현의 잠재적인 가능성으로 인해 병용투여 금기 |
| HMG-CoA 환원효소 억제제 | 로바스타틴 심바스타틴 | ↑로바스타틴 ↑심바스타틴 | 횡문근 융해증을 포함하는 근육병증의 잠재적인 가능성으로 인해 병용투여 금기 이 약의 투여 시작으로부터 최소 12시간 전에 로바스타틴 및 심바스타틴의 사용을 중단할 것 |
| HMG-CoA 환원효소 억제제 | 아트로바스타틴 로수바스타틴 | ↑아트로바스타틴 ↑로수바스타틴 | 이 약을 투여하는 동안 아트로바스타틴과 로수바스타틴의 일시적인 중단을 고려할 것 |
| 호르몬 피임제 | 에티닐에스트라디올 | ↓에티닐에스트라디올 | 추가적인 비호르몬 피임법을 고려할 것 |
| 면역 억제제 | 사이클로스포린 타크리로무스 시롤리무스 | ↑사이클로스포린 ↑타크리로무스 ↑시롤리무스 | 면역 억제제에 대한 치료 농도 모니터링이 권장되며, 혈청 농도 모니터링이 어려운 경우 이 약의 사용은 권장되지 않음 이 약과 시롤리무스의 병용투여는 권장되지 않음 추가적인 정보는 해당 면역 억제제의 허가사항을 참고할 것 |
| 지속형 베타-아드레날린 수용제 작용제 | 살메테롤 | ↑살메테롤 | QT 연장, 심계항진, 동성 빈맥(sinus tachycardia)을 포함하여 살메테롤과 관련된 심혈관 부작용의 위험을 증가시킬 수 있는바, 병용투여가 권장되지 않음 |
| 마약성 진통제 | 펜타닐 | ↑펜타닐 | 병용투여 시 치료 및 이상반응(치명적인 호흡억제 포함)에 대한 모니터링이 권장됨 |
| 마약성 진통제 | 메타돈 | ↓메타돈 | 메타돈을 투여받고 있는 환자에서 이 약을 병용하여 투여할 경우, 환자를 모니터링하여 메타돈 금단 효과의 여부를 확인하고 그에 따라 메타돈 용량조절을 고려할 것 |
| PDE5 억제제 | 폐동맥 고혈압 치료제로 사용되는 실데나필(레바티오®) | ↑실데나필 | 시각 이상, 저혈압, 발기 시간 지연 및 실신을 포함한 실데나필 관련 이상반응의 가능성으로 인해 병용투여 금기 |
| 진정제/수면제 | 트리아졸람 미다졸람(경구용) | ↑트리아졸람 ↑미다졸람 | 과도한 진정 및 호흡억제의 가능성으로 인해 병용투여 금기 |
| 진정제/수면제 | 미다졸람(비경구용) | ↑미다졸람 | 호흡억제 및/또는 진정의 지연에 대한 임상 모니터링이 가능하고 적절한 의학적 관리가 가능한 환경에서만 병용투여가 가능함 1회 이상의 미다졸람 투여가 필요한 경우, 미다졸람의 용량감량을 고려할 것 추가적인 정보는 미다졸람의 허가사항을 참고할 것 |
| 전신 코르티코스테로이드 | 베타메타손 부데소니드 시클레소니드 덱사메타손 플루티카손 메틸프레드니솔론 모메타손 프리드니손 트리암시놀론 | ↑코르티코스테로이드 | 쿠싱 증후군 및 부신 억제의 위험이 증가함 베클로메타손과 프레드니솔론을 포함하는 다른 코르티코스테로이드로의 대체를 고려할 것 |
a 니르마트렐비르/리토나비르를 사용하여 수행된 약동학, 약물 상호작용 시험(전문가를 위한 정보 항) 참조
- 임부 및 수유부에서의 투여
1) 임부
(1) 위험성요약
니르마트렐비르를 임부에게 투여한 후 약물과 관련된 주요 선천적 기형, 유산, 산모 또는 태아에 대한 이상반응을 관찰한 자료는 없다. 리토나비르를 임부에게 사용한 관찰 연구에서 리토나비르에 의한 주요 선천적 기형의 위험 증가는 관찰되지 않았다. 리토나비르의 투여와 관련하여 유산의 위험을 확인할 수 있는 충분한 문헌은 없다. 임신 중 치료되지 않은 코로나19는 산모 및 태아에 위험이 있다.
임신한 토끼에게 니르마트렐비르를 경구투여한 후 관찰한 배태자 발달 독성시험 결과, 이 약의 승인된 사람 용량에서의 인체 노출도 대비 약 10배 이상의 전신 노출(AUC)에 해당하는 동물 용량 투여군에서 감소된 태아 체중이 관찰되었다. 이 약의 승인된 사람 용량에서의 인체 노출도 대비 약 3배 이상의 전신 노출(AUC)에 해당하는 동물 용량 투여군에서는 니르마트렐비르의 투여와 관련된 발달 독성이 관찰되지 않았다.
임신한 랫드 및 토끼에 리토나비르를 경구투여한 후 생식 독성시험 결과, 리토나비르의 임상 용량 또는 이 약의 승인된 사람 용량에서의 인체 노출도 대비 약 3배 이상의 전신 노출(AUC)에 해당하는 동물 용량 투여군에서 리토나비르의 투여와 관련된 발달 독성은 관찰되지 않았다.
이 약의 신청 적응증에 대하여 예상되는 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않다. 모든 임신에는 선천적 결함, 유산 또는 기타 불리한 결과의 위험이 있다. 미국의 전체 인구에서 임상적으로 인정되는 임신 중 주요 선천적 기형과 유산의 추정 위험은 각각 2~4% 및 15~20%이다.
(2) 임상적 고려사항(산모 또는 태아 위험)
임신 중 코로나19의 감염은 자간전증, 자간증, 조산, 조기 양막 파열, 정맥 혈전 색전증 및 태아 사망을 포함하는 산모 및 태아 이상반응과 관련이 있다.
(3) 사람에 대한 자료
< 리토나비르 >
리토나비르-함유 약물에 노출된 출생아(임신 1기에 노출된 3,400명 이상, 임신 2/3분기에 노출된 3,500명 이상 포함)에 대한 항레트로바이러스 임신 레지스트리(Antiretroviral Pregnancy Registry, APR)의 전향적(prospective) 보고서에 따르면, 미국 메트로폴리탄 애틀랜타 선천적 결함 프로그램(MACDP)의 미국기준 인구에서 2.7%의 배경 선천적 결함률과 비교했을 때, 리토나비르의 전체 선천성기형의 비율에는 차이가 없었다. 출생 초기에 리토나비르-함유 약물에 노출된 후 출생결함의 유병률은 2.3% (95%신뢰구간[CI]: 1.9%-2.9%)였고, 리토나비르 함유요법에 두번째 및 세번째 삼분기 노출 후 2.9% (95% 신뢰구간: 2.4%-3.6%)였다. 리토나비르의 태반전달 및 태아에서의 리토나비르 농도는 일반적으로 낮지만, 제대혈 샘플과 신생아 모발에서 검출가능한 수준이 관찰되었다.
(4) 동물 자료
< 니르마트렐비르 >
배태자 발달 독성시험(EFD)은 기관형성기에 최대 1,000mg/kg/day의 경구 니르마트렐비르를 투여한 임신한 랫드와 토끼에서 수행되었다[랫드 임신(GD) 6−17일, 토끼 임신 6−19일]. 랫드 EFD 연구에서 생물학적으로 유의한 발달관련 영향은 관찰되지 않았다. 최고 용량인 1,000 mg/kg/day에서 랫드의 전신 니르마트렐비르 노출(AUC24)은 인체에 승인된 이 약 용량의 임상노출보다 약 8배 더 높았다. 토끼 EFD 시험에서 1,000 mg/kg/day에서 유의미한 모체 독성 소견 없이 태아 체중 감소(9% 감소)가 관찰되었다. 1,000 mg/kg/day에서 토끼의 전신노출(AUC24)은 인체에 승인된 이 약 용량의 임상노출보다 약 10배 더 높았다. 시험된 최고용량인 1,000 mg/kg/day에서 다른유의한 발달독성(기형 및 배태자 치사율)은 관찰되지 않았다. 인체에 승인된 이 약 용량에서의 임상노출 보다 약3배 높은 전신노출(AUC24) 수준인 300 mg/kg/day를 토끼에게 투여 시 발달 관련 영향이 관찰되지 않았다. GD6일부터 수유일(LD) 20일까지 최대 1,000 mg/kg/day의 니르마트렐비르를 경구 투여한 임신한 랫드에 대한 산전/산후 발달(PPND) 시험이 진행 중이며, 현재는 출생 후일(PND) 56일까지의 중간 자료만 있다. 니르마트렐비르를 투여한 동물과 대조군 동물 태자를 비교하면 출생 시 체중의 차이가 나타나지 않았지만 PND17일에서 태자의 체중감소(수컷 및 암컷에서 8%)가 관찰되었다. PND 28−56일까지 관찰된 태자 체중에는 유의한 차이가 없었다. 1,000 mg/kg/day에서 모체의 전신노출(AUC24)은 인체에서 승인된 이 약 용량의 임상노출보다 약 8배 더 높았다. 300 mg/kg/day에서는 태자의 체중변화가 관찰되지 않았으며, 결과적으로 전신노출(AUC24)은 인체에 승인된 이 약 용량에서의 임상노출보다 약 5배 더 높았다.
< 리토나비르 >
리토나비르는 기관형성 동안(각각 임신일 6−17일과 6−19일)에 임신한 랫드(0, 15, 35 및 75 mg/kg/day용량)와 토끼(0, 25, 50 및 110 mg/kg/day용량)에 경구투여되었다. 인체에 승인된 이 약 용량 보다 약 4배 더 높은 전신노출(AUC)시 랫드와 토끼에서 리토나비르로 인한 기형발생의 증거는 없었다.
인체에 승인된 이 약 용량 보다 약 4배 더 높은 전신노출 시 랫드에서의 모체독성은 조기 재흡수, 골화지연 및 발달변이의 발생률 증가와, 태자 체중감소로 관찰되었다. 인체에 승인된 이 약 용량의 약 5배에 노출된 랫드(모체 독성 투여량)에서 잠복고환증의 발생률이 약간 증가한 것으로 나타났다. 토끼의 경우 체표면적 환산 계수를 기준으로 인체에 승인된 이 약 용량보다 약11배 높은 모체독성 용량에서 재흡수, 한배새끼의 크기 감소 및 태자 체중감소가 관찰되었다. 랫드를 대상으로 한 출생 전/후 발달시험에서, 체표면적 환산 계수를 기준으로 인체에 승인된 이 약 용량보다 약3배 높은 리토나비르 용량에서 임신일 제6일부터 출산 후 20일까지 0, 15, 35 및 60 mg/kg/day리토나비르를 투여한 결과 발달독성이 나타나지 않았다.
2) 수유부
니르마트렐비르가 사람 또는 동물 모유에 존재하는지, 수유받는 유아 또는 모유생성에 미치는 영향에 대한 자료는 없다. 니르마트렐비르를 투여한 랫드의 수유 중인 태자에서 일시적인 체중감소가 관찰되었다. 제한적인 발표자료에서 사람 모유에 리토나비르가 존재하는 것으로 보고되었다. 리토나비르가 모유수유한 유아나 모유생산에 미치는 영향에 대한 정보는 없다. 모유 수유가 주는 발달 및 건강상 이점과 모체에서 이 약의 임상적 필요성 및 이 약 또는 모체의 기저상태로 인해 모유수유 중인 유아에 미칠 수 있는 잠재적인 이상반응을 함께 고려해야 한다. 코로나 19에 감염된 모유 수유자는 유아가 코로나 19에 노출되지 않도록 임상지침에 따라야 한다.
(1) 자료
출생 전 및 출생 후 발달 연구에서 니르마트렐비르를 투여한 임신한 랫드의 전신노출(AUC24)이 인체에서 승인된 이 약 용량에서의 임상노출보다 약 8배 더 높을 때 태자의 체중감소(최대 8%)가 관찰되었다. 인체에 승인된 이 약 용량에서 임상노출 보다 모체의 전신노출(AUC24) 수준이 약 5배 더 높은 수준에서는 태자의 체중변화가 관찰되지 않았다.
3) 여성 및 남성에서의 수태능
리토나비르의 사용은 복합 호르몬 피임제의 유효성을 감소시킬 수 있다. 복합 호르몬 피임제를 사용하는 환자에게 효과적인 대체 피임법 또는 추가적인 차단 피임법을 사용하도록 한다.
- 소아에 대한 투여
이 약은 만 12세 미만 또는 체중 40kg 미만의 소아환자에게 사용이 승인되지 않았다. 소아환자에 대한 이 약의 안전성과 유효성은 확립되지 않았다.
체중이 최소 40kg인 만 12세 이상의 환자에게 성인과 동일한 용량 투여 시 성인에서 관찰된 니르마트렐비르와 리토나비르의 혈청 농도와 유사할 것으로 예상되며, 이와 같은 체중을 가진 성인이 임상시험 EPIC-HR에 포함된 바 있다.
- 고령자에 대한 투여
이 약의 임상시험에는 만 65세 이상 대상자를 포함하며, 이들 자료는 전체 안전성 및 유효성 평가에 기여한다. 이 약에 무작위 배정된 EPIC-HR의 총 참가자(N=1,120) 중, 13%가 만 65세 이상이었고, 3%는 만 75세 이상이었다.
- 과량투여시의 처치
이 약 과량투여에 대한 처치는 환자의 활력징후 모니터링과 임상상태 관찰을 포함한 일반적 지지요법으로 이루어져야 한다. 이 약 과량투여에 대한 특정 해독제는 없다.
- 전문가를 위한 정보
1) 작용기전
니르마트렐비르는 SARS-CoV-2 주요 단백질분해효소(Mpro), 또는 3C유사 단백질분해효소(3CLpro) 또는 nsp5 단백질분해효소라고도 하는 모방 단백질분해효소 억제제이다. SARS-CoV-2 Mpro가 억제되면 다단백질 전구체를 처리할 수 없어 바이러스 복제를 방지한다. 니르마트렐비르는 생화학적 분석에서 재조합 SARS CoV-2 Mpro의 활성을 억제했으며, Ki 값은 3.1nM, IC50 값은 19.2nM였다.
X선 결정학에서, 니르마트렐비르는SARS-CoV-2 Mpro 활성부위에 직접 결합하는 것으로 나타났다.
리토나비르는 HIV-1 단백질분해효소 억제제이지만 SARS-CoV-2 Mpro 에 대해서는 활성이 아니다. 리토나비르는 니르마트렐비르의 CYP3A 매개대사를 억제한 결과 니르마트렐비르의 혈장농도를 증가시킨다.
2) 약동학적 정보
니르마트렐비르/리토나비르의 약동학이 건강한 대상자를 대상으로 연구되었다. 리토나비르는 니르마트렐비르의 전신농도를 증가시키고 반감기를 늘리는 약동학적 증강제로서, 니르마트렐비르와 함께 1일 2회 투여 요법을 권장한다.
니르마트렐비르/리토나비르의 경구투여 시 전신 노출의 증가는 단회투여로 최대 750 mg 및 다회투여로 1일 2회 최대 500 mg까지 용량비례 보다 적은 것으로 나타났다. 10일에 걸쳐 1일 2회 투여시 약2배 축적으로 2일차에 항정상태에 도달했다. 니르마트렐비르/리토나비르의 약동학적 특성은 표 2에 있다.
표 2: 건강한 대상자에서 니르마트렐비르 및 리토나비르의 약동학적 특성
| 니르마트렐비르 (리토나비르와 함께 투여 시) | 리토나비르 | |
| 흡수 | ||
| Tmax (h), 중앙값 | 3.00a | 3.98a |
| 분포 | ||
| % 사람 혈장 단백질 결합 | 69% | 98-99% |
| 혈액-혈장비 | 0.60 | 0.14c |
| Vz/F (L), 평균 | 104.7b | 112.4b |
| 제거 | ||
| 주요 제거 경로 | 신 제거 d | 간 대사 |
| 반감기(t1/2) (hr), 평균 | 6.05a | 6.15a |
| 경구 청소율 (CL/F), 평균 | 8.99b | 13.92b |
| 대사 | ||
| 대사 경로 | 최소d | 주요 CYP3A4,경미 CYP2D6 |
| 분비 | ||
| % 분변 내 약물관련 물질 | 49.6%e | 86.4%f |
| % 소변 내 약물관련 물질 | 35.3%e | 11.3%f |
a. 건강한 대상자에서 100 mg 리토나비르정과 함께 300 mg 니르마트렐비르(2정 x 150 mg)를 단회 투여한 후의 자료
b. 300 mg 니르마트렐비르(경구 현탁액제) 및 100 mg 리토나비르(정)를 3일간 1일 2회 병용투여
c. 적혈구 대 혈장 비율
d. 니르마트렐비르는 CYP3A4 기질이지만 리토나비르와 병용투여하면 대사 제거율이 최소화 됨
e. -12시간, 0시간, 12시간 및 24시간에 100 mg 리토나비르로 증강한 300 mg 경구 현탁액 처리 후 19F-NMR 분석으로 확인
f. 리토나비르 경구용액 600 mg 처리 후 14C 분석으로 결정.
건강한 대상자에게서의 이 약의 단회투여 약동학 자료는 아래와 같다.(표 3)
표 3: 건강한 대상자에 300 mg/100 mg 니르마트렐비르/리토나비르를 투여한 후 니르마트렐비르의 단회투여 약동학
| PK 매개변수(단위) | 니르마트렐비르(N=12) |
| Cmax (µg/mL) | 2.21 (33) |
| AUCinf (µg*hr/mL) | 23.01 (23) |
| Tmax (hr) | 3.00 (1.02-6.00) |
| T1/2 (hr) | 6.05 ± 1.79 |
* 니르마트렐비르 2정 x 150mg의 자료를 나타냄. 값은 Tmax에 대한 중앙값(범위)과 T1/2에 대한 산술평균 ± SD이외에는 기하평균(기하학적 % CV)으로 나타냄.
(1) 음식물이 니르마트렐비르 경구흡수에 미치는 영향
니르마트렐비르 현탁제와 리토나비르 정제의 병용시 고지방 음식과 함께 투여하면 공복상태에 비해 니르마트렐비르 노출이 약간 증가했다(평균Cmax의 약 15%증가 및 평균AUClast의 1.6%증가)
(2) 특수 집단
니르마트렐비르/리토나비르의 연령 및 성별관련 약동학은 평가되지 않았다.
< 소아 환자 >
18세 미만 환자에 대한 니르마트렐비르/리토나비르의 약동학은 평가되지 않았다.
집단 PK 모델을 사용했을 때, 체중 40kg 이상의 만12세 이상 환자에서 체중을 조정한 후 성인과 동일한 용량 투여 시 성인에서 관찰된 니르마트렐비르와 리토나비르의 항정 상태 혈장노출과 유사할 것으로 예상된다.
< 인종 또는 민족 >
일본인 대상자에서 전신노출은 수치적으로 더 낮았지만 서양인 대상자 대비 임상적으로 유의미한 차이는 없었다.
< 신장애 환자 >
공개라벨 시험에서 건강한 성인 대상자와 경증(eGFR ≥60 ~ <90 mL/min), 중등도(eGFR ≥30 ~ <60 mL/min), 중증(eGFR <30 mL/min) 신장애 대상자에서 -12, 0, 12 및 24시간에 니르마트렐비르 100 mg을 1회 경구 투여하고 리토나비르 100 mg을 투여한 후, 니르마트렐비르/리토나비르 약동학을 비교했다. 신장애가 없는 건강한 대조군에 비해, 경증 신장애 환자에서 니르마트렐비르의 Cmax와 AUC는 30% 및 24% 더 높았으며, 중등도 신장애 환자에서는 38% 및 87% 더 높았고, 중증 신장애 환자에서는 각각 48% 및 204% 더 높았다(표 4).
표 4: 신장애가 니르마트렐비르/리토나비르 약동학에 미치는 영향
| 정상 신기능 (n=8) | 경증 신장애 (n=8) | 중등도 신장애 (n=8) | 중증 신장애 (n=8) | |
| Cmax (µg/mL) | 1.60 (31) | 2.08 (29) | 2.21 (17) | 2.37 (38) |
| AUCinf (µg*hr/mL) | 14.46 (20) | 17.91 (30) | 27.11 (27) | 44.04 (33) |
| Tmax (hr) | 2.0 (1.0 – 4.0) | 2.0 (1.0 – 3.0) | 2.50 (1.0 – 6.0) | 3.0 (1.0 – 6.1) |
| T1/2 (hr) | 7.73 ± 1.82 | 6.60 ± 1.53 | 9.95 ± 3.42 | 13.37 ± 3.32 |
* 값은 Tmax에 대한 중앙값(범위)과 T1/2에 대한 산술평균 ± SD이외에는 기하평균(기하학적 % CV)으로 나타냄.
< 간장애 환자 >
중등도의 간장애가 있는 대상자에서 니르마트렐비르 100 mg 단일 경구용량과 함께 -12시간, 0시간, 12시간 및 24시간에 리토나비르 100 mg을 투여하였을 때 정상 간기능을 가진 대상자와 유사한 노출결과가 나타났다 (표 5).
표 5: 간장애가 니르마트렐비르/리토나비르 약동학에 미치는 영향
| 정상 간기능 (n=8) | 중등도 간장애 (n=8) | |
|---|---|---|
| Cmax (µg/mL) | 1.89 (20) | 1.92 (48) |
| AUCinf (µg*hr/mL) | 15.24 (36) | 15.06 (43) |
| Tmax (hr) | 2.0 (0.6 – 2.1) | 1.5 (1.0 – 2.0) |
| T1/2 (hr) | 7.21 ± 2.10 | 5.45 ± 1.57 |
* 값은 Tmax에 대한 중앙값(범위)과 T1/2에 대한 산술평균 ± SD이외에는 기하평균(기하학적 % CV)으로 나타냄. 중증 간장애 대상자에서 니르마트렐비르/리토나비르는 시험되지 않았다.
(3) 니르마트렐비르에 대해 수행된 약물상호작용 시험
시험관내(In vitro) 자료는 니르마트렐비르가 사람 MDR1(P-gp) 및 3A4에 대한 기질이지만 사람 BCRP, MATE1, MATE2K, NTCP, OAT1, OAT2, OAT3, OCT1, OCT2, PEPT1, OATP 1B1, 1B3, 2B1 또는 4C1에 대한 기질이 아님을 나타냈다.
In vitro 시험에서, 니르마트렐비르는 임상적으로 관련된 농도에서CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6를 가역적으로 억제하지 않았다.
니르마트렐비르는 가역적 그리고 시간 의존적으로 CYP3A4 및 MDR1(P-gp)을 억제할 가능성이 있다. 니르마트렐비르는 임상적으로 관련된 농도에서 CYP를 유도하지 않는다.
(4) 리토나비르에 대해 수행된 약물상호작용 시험
시험관내(In vitro) 연구는 리토나비르가 주로 CYP3A의 기질임을 시사한다. 또한 리토나비르는 이소프로필티아졸 산화 대사물질 M2의 형성에 기여하는 CYP2D6의 기질인 것으로 보인다.
리토나비르는 CYP3A의 억제제이며, 그 정도는 CYP2D6에서 덜하다. 리토나비르는 CYP3A, CYP1A2, CYP2C9, CYP2C19, CYP2B6 및 글루쿠로노실 전이효소를 포함한 다른 효소를 유도하는 것으로 보인다.
이 약과 이트라코나졸(CYP3A 억제제) 및 카르바마제핀(CYP3A 유도제)의 병용투여가 니르마트렐비르의 AUC 및 Cmax에 미치는 영향이 표 6에 요약되어 있다(다른 약물이 니르마트렐비르에 미치는 영향).
표 6. 약물 상호작용: 병용 약물이 있을 시 니르마트렐비르에 대한 약동학 매개변수
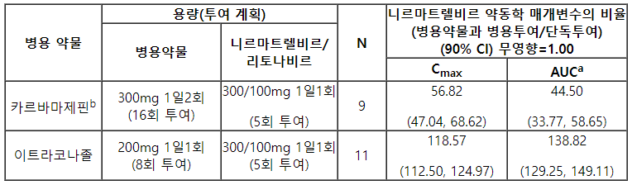
a 카르바마제핀의 경우 AUC=AUCinf, 이트라코나졸의 경우 AUC=AUCtau.
b 카르바마제핀은 8일 -15일까지 1일 2회 최대 300 mg으로 적정 되었다 (예: 1일부터 3일까지 100 mg을 1일 2회, 4일부터 7일까지 200 mg을 1일 2회)
3) 미생물학
(1) 항바이러스 활성
니르마트렐비르는 약물 노출 3일 이후, 분화된 정상 사람 기관지 상피세포인 dNHBE 세포의 SARS-CoV-2(USA-WA1/2020 분리주)감염에 대해 항바이러스 활성(각각 EC50 및 EC90 값 62 nM 및 181 nM)을 나타냈다.
니르마트렐비르는 알파(B.1.1.7), 베타(B.1.351), 감마(P.1), 델타(B.1.617.2) 및 람다(C.37) 변이에 속하는 SARS-CoV-2분리주에 대하여 유사한 세포배양 항바이러스 활성을 갖는다. 베타(B.1.351) 변이체는 USA WA1/2020 분리주에 비해 약 3배 감소된 감수성을 가진 가장 취약한 시험 변종이었다.
세포 배양에서 SARS-CoV-2 오미크론(B.1.1.529) 변이체에 대한 니르마트렐비르의 활성에 관한 자료는 없다. 그러나 생화학적 분석에서 오미크론 변이체에서 발견된 Mpro P132H 치환은 USA WA1/2020 효소에 비해 니르마트렐비르 활성(Ki 배수 변화 <1)을 감소시키지 않았다.
(2) 동물 모델에서 SARS-CoV-2에 대한 항바이러스 활성
니르마트렐비르는 BALB/c 및 129개 마우스 계통내 마우스 적응 SAR-CoV-2 감염이 있는 마우스 종에서 항바이러스 활성을 보였다. 접종 4시간 후에 개시된 300 mg/kg 또는 1,000 mg/kg 니르마트렐비르 1일 2회 또는 접종 12시간 후에 개시된 1,000 mg/kg 니르마트렐비르 1일 2회 경구투여 시 위약을 투여한 동물 대비 폐 바이러스 역가감소 및 질환의 개선지표(체중 감소 및 폐 병리학)가 나타났다.
(3) 항바이러스 내성
표현형 평가는 재조합 Mpro 효소를 사용한 생화학적 분석에서 자연 발생 SARS CoV 2 Mpro 다형성이 니르마트렐비르의 활성에 미치는 영향의 특성을 분석하기 위해 수행되었다. 이러한 다형성의 임상적 중요성은 알려져 있지 않으며 생화학적 분석 결과가 세포 배양에서 항바이러스 활성을 예측하는지 여부도 알려져 있지 않다. 다음의 Mpro 아미노산 치환은 니르마트렐비르 활성 감소(≥3배 더 높은 Ki 값)와 연관되었다: G15S(4.4배), T135I(3.5배), S144A(91.9배), H164N(6.4배), H172Y(233배), Q189K(65.4배) 및 D248E(3.7배). G15S는 세포배양에서 니르마트렐비르(USA WA1/2020에 비해)에 대한 감수성을 감소시키지 않은 람다 변이체에 존재한다. 또한, 다형성이 자연적으로 관찰되지 않은 3개의 SARS-CoV-2 Mpro 아미노산 위치를 바로 그 위치에서 알라닌으로 치환하고 활성에 미치는 영향을 생화학적 분석으로 평가하였다. 이런 Mpro 아미노산 치환은 니르마트렐비르 활성 감소(즉, 더 높은 Ki 값)와 연관되었다: Y54A(23.6배), F140A(39.0배) 및 E166A(33.4배). 이러한 Mpro 위치에서 치환의 임상적 중요성은 알려져 있지 않다.
마우스 간염 바이러스(MHV, 대용으로 사용되는 베타 코로나바이러스)를 사용한 니르마트렐비르 세포배양 내성 선택 연구에서 Mpro 아미노산 P15A, T50K, P55L, T129M 및/또는 S144A의 치환이 나타났다. 이러한 변화의 임상적 관련성은 알려져 있지 않다. P55L 및 S144A치환의 존재는 니르마트렐비르 감수성 감소와 연관되었다(EC50 값이 ~4-5배 더 높음). 이 위치는 각각 SARS-CoV-2 Mpro의 E55 및 S144에 해당한다. 생화학적 분석에서는 E55L 단독으로는 니르마트렐비르의 SARS-CoV-2 Mpro에 대한 활성에 영향을 미치지 않았으나, S144A는 니르마트렐비르 활성을 91.9배 감소시켰다(Ki 값 기준).
제한된 SARS-CoV-2 염기서열 분석 자료는 임상시험에서 니르마트렐비르 내성을 특성화 하는데 사용할 수 있다. 서열 분석 자료가 있는 임상 시험 EPIC-HR에서 SARS-CoV-2 Mpro 치환 A260V(n=3) 또는 A260T(n=1)는 니르마트렐비르/리토나비르 치료 대상자의 4%(4/97)에서 나타났다. A260T 및 A260V 치환은 공개된 SARS CoV 2 서열(2021년 12월 5일 기준)에서 드물게 발생하는 자연발생 다형성이다. 생화학적 분석에서 A260V Mpro 치환은 니르마트렐비르 활성을 감소시키지 않았다(Ki 배수 변화 <1).
니르마트렐비르와 항SARS-CoV-2 단클론항체 또는 렘데시비르의 작용기전에 차이가 있으므로 교차 내성은 예상되지 않는다
4) 중증 코로나19 질환으로 진행될 위험이 높은 대상자에서의 유효성
이 약의 자료는 SARS-CoV-2 감염이 확진된 입원하지 않은 유증상 성인 대상자를 대상으로한 제2/3상, 무작위, 이중맹검, 위약대조 시험인 EPIC-HR(NCT04960202)의 분석을 기반으로 한다. 임상시험 대상자는 당뇨병, 과체중(BMI ≥25), 만성 폐질환(천식 포함), 만성 신장질환, 현재 흡연자, 면역억제성 질환 또는 면역억제 치료, 심혈관계 질환, 고혈압, 겸상적혈구 질환, 신경발달 장애, 활동성 암, 의학관련 기술의존성 상태 등의 중증 질환으로의 진행 가능성 위험인자를 한가지 이상 가지고 있는 만 18세 이상의 성인이거나, 이런 동반 질환에 관계없는 60세이상의 고령 환자였다.
시험약 투여시작 이전 5일 내에 코로나19 증상이 발현된 대상자가 시험에 포함되었다.
대상자는 무작위 배정되어(1:1) 5일동안 매12시간마다 이 약(니르마트렐비르 300mg/리토나비르 100mg) 또는 위약을 경구투여했다. 이전 코로나19 감염 또는 백신접종의 이력이 있는 사람은 이 시험에서 제외되었다. 1차유효성 평가변수는 제28일까지의 코로나19 관련 입원 또는 사망(원인 불문) 환자의 비율이었다. mITT 분석군(베이스라인에서 코로나 19 치료 mAb 치료를 받지 않았거나 받을 것으로 예상되는 ≤3일의 증상발병을 가진 모든 치료 대상자), mITT1 분석군(베이스라인에서 코로나 19 치료 mAb 치료를 받지 않았거나 받을 것으로 예상되는 ≤5일의 증상발병을 가진 모든 치료 대상자) 및 mITT2 분석 세트(증상 발병 ≤5일의 모든 치료 대상자)를 대상으로 분석을 수행하였다.
총 2,246명의 대상자가 이 약 또는 위약에 무작위 배정되었다. 베이스라인에서 평균 연령은 만46세였으며, 51%는 남성, 72%는 백인, 5%는 흑인 및 14%는 아시아인, 45%는 히스패닉계 또는 라틴계이었다.
대상자 중 66%는 시험약 투여시작 이전 3일 이내에 증상이 발현되었으며, 대상자 중 47%는 베이스라인의 혈청학적 검사에서 음성이었다. 평균(SD) 베이스라인 바이러스 부하는 4.63 log10 copies/mL(2.87)이었고, 26%는 베이스라인에서 바이러스 부하가 >10^7(units)이었다. 대상자 중 6%는 무작위 배정시 코로나19 치료용 단클론 항체를 받고 있거나 받을 것으로 예상되었으며, mITT 및 mITT1 분석에서 제외되었다.
베이스라인에서의 인구학적 특성과 질병특성은 이 약 투여군과 위약군간에 균형을 이루었다.
표 7은 mITT1 분석 모집단의 1차 평가변수 결과이다. 1차 평가변수의 경우 위약에 비해 이 약에 대한 mITT1 분석 모집단의 상대적 위험감소는 88%(95% CI: 75%, 94%)였다.
표 7: 베이스라인에서 코로나 19 단일클론항체 치료를 받지 않았으며, 코로나 19감염으로 입원하지 않고 증상 발병 후5일 이내에 이 약을 투여한 성인의 효능 결과(mITT1 분석 세트)
| 이 약 (N=1,039) | 위약 (N=1,046) | |
| 28일 차까지 코로나 19 관련 입원 또는 모든 원인의 사망 | ||
| n (%) | 8 (0.8%) | 66 (6.3%) |
| 위약 대비 감소 a [95% CI], % | -5.62 (-7.21, -4.03) | |
| 28일 차까지 모든 원인의 사망, % | 0 | 12 (1.1%) |
약어: CI=신뢰구간
a 1차 효능 측정은 mITT 모집단에서 대상자 780명에 대해 계획된 중간 분석을 기반으로 한다. 추정 위험 감소율은 95% CI(-9.0%, -3.6%) 및 양측 p-값 <0.0001에서 -6.3%였다.
제28일까지 입원 또는 사망한 참가자의 추정 누적 비율은 Kaplan-Meier 방법을 사용하여 각 치료군에 대해 계산했으며, 여기서 제28일까지의 입원 및 사망 상태가 아닌 대상자는 시험 중단 시점에 제외했다.
mITT 및 mITT2 분석 모집단에서 일관된 결과가 관찰되었다. mITT 분석 모집단에는 총 1,379명의 대상자가 포함되었다. 사례 발생률은 이 약 시험군이 5/697(0.72%), 위약군이 44/682(6.45%)였다. 두 치료군에 걸쳐 있는 1차 SARS-CoV-2 변이체는 21J, 21A 및 21I 계통군을 포함하여 델타(98%)였다.
대상자 하위집단에서 유사한 경향이 관찰되었다(그림 1 참조). 이러한 하위집단 분석은 탐색적 분석으로 간주한다.
그림 1 : 코로나 19감염 성인에서 증상 발병 후 5일 이내에 이 약을 투여 했을 때, 28일 차까지의 코로나19 관련 입원 또는 모든 원인으로 인한 사망(시험계획서 C4671005)
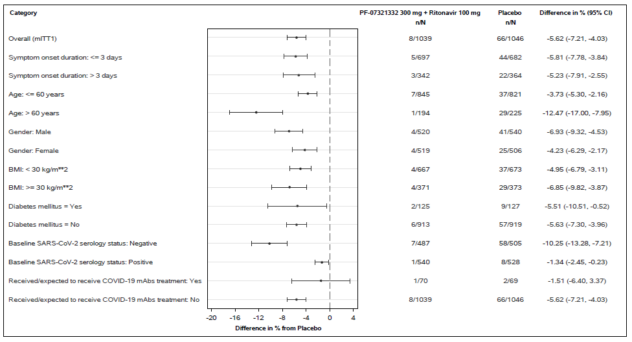
N=분석 세트 범주의 참가자 수.
모든 범주는 mITT2 모집단을 기반으로 하는 코로나19 mAb 치료를 제외한 mITT1 모집단을 기반으로 한다.
Elecsys 항SARS CoV-2 S 또는 Elecsys SARS CoV-2(N) 분석 결과가 양성인 경우 혈청 양성으로 정의했다.
자료의 정규근사를 기반으로 하는 2개의 치료군 및 95% 신뢰 구간의 비율 차이를 표시했다.
위약에 비해 이 약의 치료는 5일차까지 비인두 샘플에서 바이러스 RNA 수준이 약 0.9 log10 copy/mL 더 많이 감소했으며 mITT, mITT1 및 mITT2 분석집단에서 유사한 결과가 관찰되었다.
5) 독성시험정보
(1) 발암성, 변이성, 수태능 장애
< 니르마트렐비르 >
니르마트렐비르는 발암성에 대해 평가되지 않았다.
니르마트렐비르는 S. typhimurium 및 E. coli를 사용한 Ames 박테리아 복귀돌연변이시험, 인간 림프모구 TK6 세포를 사용한 in vitro 소핵 분석 및 in vivo 랫드를 포함한 일련의 in vitro 및 in vivo 분석에서 돌연변이 또는 염색체 이상 활성에 대해 음성이 나왔다.
수태능 및 초기 배아발달 연구에서, 교미 14일전부터 짝짓기 단계 전반에 걸쳐 니르마트렐비르 60, 200 또는 1,000 mg/kg/day용량이 수컷 및 암컷 랫드에게 경구 투여되었으며, 암컷은 임신 제6일까지, 수컷은 총 32회 투여되었다. 이 약의 승인된 사람 용량에서의 노출보다 약 4배 더 높은 전신노출(AUC24)인 최대 1,000 mg/kg/day용량까지 수태능, 생식능력 또는 초기 배아발달에 미치는 영향은 없었다.
< 리토나비르 >
리토나비르에 대한 마우스와 랫드 발암성 시험이 수행되었다. 수컷 마우스의 50, 100 또는 200mg/kg/day 수준에서 간에서의 샘종과 결합 샘종 및 암종의 발병률이 용량 의존적으로 증가했다. AUC 측정치를 기준으로, 고용량에서의 노출은 인체에 승인된 이 약 용량에서의 사람 노출보다 약 2배 더 높았다(수컷). 암컷에서는 시험된 용량에서 발암성이 나타나지 않았다. 고용량에서의 노출은 인체에 승인된 이 약 용량에서의 사람 노출보다 약 4배 더 높았다(암컷). 7, 15 또는 30 mg/kg/day 수준으로 랫드에서 발암성이 없었다. 이 시험에서 고용량의 노출은 인체에 승인된 이 약 용량에서의 사람 노출의 약 36%였다.
리토나비르는 S. typhimurium 및 E. coli를 이용한 Ames 박테리아 복귀돌연변이시험, 마우스 림포마시험, 마우스 소핵시험 및 사람 림프구내 염색체이상시험 등 다양한 시험관 내 및 생체 내 시험에서 변이성 또는 염색체이상유발성에 음성으로 확인되었다.
리토나비르는 이 약의 인체에 승인된 용량에서 사람 노출보다 약 2배(수컷) 및 4배(암컷) 더 높은 약물 노출 시 랫드의 수태능에 영향을 미치지 않았다.
(2) 동물 독성학 및/또는 약리학
니르마트렐비르에 대한 연구에는 랫드(14일) 및 원숭이(15일)에 대한 반복투여 독성연구가 포함되었다. 랫드에서 최대 1,000 mg/kg/day로 반복 일일 경구 투여했을 때, 혈액학적, 간 및 갑상선에 대한 이상은 없었다. 모든 혈액학 및 응고학적 소견(즉, PT 및 APTT의 증가)은 임상적 또는 현미경적 상관관계가 없었고 모든 소견은 2주의 회복 기간이 끝날 때 완전히 회복되었다. 사람에 비해 특히 민감한 것으로 알려져 있는 랫드의 기전으로, 간(즉, 최소~경미한 문맥주위 간세포 비대 및 공포) 및 갑상선(즉, 갑상선 여포 세포 비대) 소견은 간에서 갑상선호르몬 제거 시 마이크로솜 효소의 유도 증가와 관련된 이차적응 효과와 일치했다. 간과 갑상선에서 관찰된 모든 소견은 중증도가 낮았고 임상병리학적 매개변수의 상관관계 변화가 없는 상태에서 발생했으며 이러한 모든 소견은 완전히 회복되었다. 최대 1,000 mg/kg/day의 용량에서 이상사례가 관찰되지 않았으며, 그 결과 인체에 승인된 이 약 용량에서의 노출보다 약 4배 더 높은 전신노출이 있었다. 원숭이에게 15일 동안 니르마트렐비르를 반복 경구 투여한 후의 관련 소견은 구토와 피브리노겐 증가로 한정되었다. 증가된 피브리노겐은 염증상태가 원인일 수 있지만 현미경적 상관관계는 부족했다. 원숭이에서 600 mg/kg/day의 고용량 전신노출은 인체에 승인된 이 약 용량에서의 노출보다 약 18배 더 높았다.
- 의약품 부작용 보고·신고
1) 해당 제품과 관련된 부작용이 발생한 경우, 환자·보호자, 의약전문가 등은 아래에 제시된 한국의약품안전관리원에 온라인 또는 전화로 직접 보고·신고할 수 있다
- 한국의약품안전관리원(KIDS)
전화: 1644-6223, 웹사이트: https://nedrug.mfds.go.kr/
2) 해당 제품과 관련된 부작용이 발생한 경우, 환자·보호자, 의약전문가 등은 한국화이자제약(주)에도 부작용을 신고할 수 있다(전화: 02-317-2114).
- 제품 관련 의학정보 문의
www.pfizermedinfo.co.kr (의료전문인용) 또는 02-317-2148
저장방법
기밀용기, 실온보관(15℃~30℃)
사용기한
제조일로부터 12개월
포장단위
30정/상자 [{(니르마트렐비르정 4정 + 리토나비르 2정)/ 블리스터 1개} x블리스터 5개/상자]
관련 게시물

- 약(藥)에 대한 전문가는 “약사(藥師)”입니다.
- 방문하시기 전에 “재고확인”이나 “수량예약”이 필요하시면 카카오톡으로 문의해주세요. 약국 실장님께서 답변드리겠습니다.
- 단, 전화나 카카오톡으로는 가격 문의를 받지 않습니다. 가격은 약국에 방문하신 고객님들께만 공개하고 있습니다.
- 약국에 방문하시는 환자분들이 많은 관계로, 전화나 카카오톡으로는 재고확인만 가능하며, 약사님께 여쭤봐야하는 약 관련 “상담”은 방문하신 고객님만 받으실 수 있습니다.
- 약에 대한 내용은 약에 대한 전문가인 약사님께 상담받는 것이 가장 정확하며, 상담이 필요하실 경우 “고객님의 주치약사님”을 찾아주시기 바랍니다.
- 성동온누리약국&금호동물약국에 “약력관리고객”으로 등록하신 고객님들께는 복용 중이신 약물들의 상호작용을 비교 분석해드리고 있습니다. 또한 약물 복용 기록을 관리해드리고 있으며, 지난번 약 복용 후 경과 및 호전 양상에 따라 적절한 의약품을 추천해드리고 있습니다.
- 또한 “약력관리고객”으로 등록하신 고객님들께서는 구매하신 제품들에 대한 자세한 안내문을 모바일로 받아보실 수 있습니다.
- 단, “약사님과의 상담 서비스”는 약국에 방문하신 환자분들과 고객님들만을 대상으로 제공되므로, 약국에 직접 방문해주셔야 합니다.
- 처방대상동물용의약품, 전문의약품 등 일부 품목은 처방전이 필요할 수 있습니다.
- 본 웹사이트 게시물의 URL은 자유롭게 공유할 수 있습니다. 단, 게시물 내용 또는 웹사이트 컨텐츠를 다른 곳에서 상업적인 목적으로 사용할 수 없으며, 이를 저장하거나 다른 곳에서 배포하고자 할 경우에는 사전에 제작자의 동의를 받아야 합니다.
- 위 제품이 “의약품”인 경우, 약사법에 따라 “의약품의 택배거래”는 불법인 관계로, 전화나 카카오톡을 통한 택배발송 요청은 불가합니다. 필요하신 경우 대리인 분이라도 약국에 방문해주셔야만 합니다.
- 위 제품이 “의약품”이 아닌 경우, 방문하지 않으셔도 택배요청을 할 수 있습니다. 의약품 여부가 불분명할 경우 카카오톡으로 문의해주세요.
감사합니다! 😄
- 더파머시
- ㄷㅍㅁㅅ
- 성동온누리약국
- ㅅㄷㅇㄴㄹ약국
- ㅅㄷㅇㄴㄹㅇㄱ
- ㅅㄷㅇㄴㄹ
- 금호동물약국
- ㄱㅎㄷㅁㅇㄱ
- ㄱㅎ동물약국
- ㄱㅎㄷㅁ약국
- 금호ㄷㅁㅇㄱ
- 금호동물ㅇㄱ
- 금호동물
- 성동동물
- 금호약국
- 금호ㅇㄱ
- ㄱㅎ약국
- ㄱㅎㅇㄱ
- 공항축산
- ㄱㅎㅊㅅ
- 청려원
- ㅊㄹㅇ
- 협성가축약품
- 가축약품
- 협성
- 협성가축약국
- 협성가축
- ㅎㅅㄱㅊㅇㅍ
- ㄱㅊㅇㅍ
- 동물병원
- 금호동물병원
- ㄱㅎ동물병원
- ㄱㅎㄷㅁㅂㅇ
- 금호ㄷㅁㅂㅇ
- 금호동물ㅂㅇ
- 금호동병
- ㄷㅁㅂㅇ
- 메디컬센터
- 메디칼센터
- ㅁㄷㅋㅅㅌ
- 약사
- 의사
- 수의사
- 가격
- price
- 금액
- amount
- 어디서
- where
- 파나
- 파나요
- buy
- 구매
- purchase
- 서울
- seoul
- 한국
- 국내
- korea
- 성동
- 성동구
- seongdong
- 금호
- kumho
- 펫
- pet
- 동물
- animal
- 강북
- 강남
- 종로
- 중구
- 동대문
- 광진
- 서초
- 서울약국
- 서울동물약국
- 서울동물약
- 서울동물
- 약국
- pharmacy
- 동물약국
- animal pharmacy
- pet pharmacy
- 더파머시
- the pharmacy
- 동물주사
- 강아지주사
- 고양이주사
- 동물주사놓는방법
- 자가접종
- 강아지
- 고양이
- 백신
- 강아지 백신
- 고양이 백신
- 강아지 자가접종
- 고양이 자가접종
- 새살연고
- EGF
- 레보티록신
- levothyroxin
- 메트로니다졸
- 메트로디나졸
- 진크피
- 임테기
- 임신테스트기
- 포러스
- 핵시딘
- 헥사딘
- 수액
- 염화나트륨
- 심장사상충
- 심장사상충약
- 외부기생충
- 내부기생충
- 외부구충제
- 내부구충제
- 강아지 감기
- 고양이 감기
- 강아지 설사
- 고양이 설사
- 강아지 변비
- 고양이 변비
- 강아지 콧물
- 고양이 콧물
- 강아지 기침
- 고양이 기침
- 강아지 해열제
- 고양이 해열제
- 기침
- 감기
- 콧물
- 해열제
- 설사
- 변비
- 신이고
- 신장질환을이긴고양이
- 고양이라서다행이야
- 아반강고


